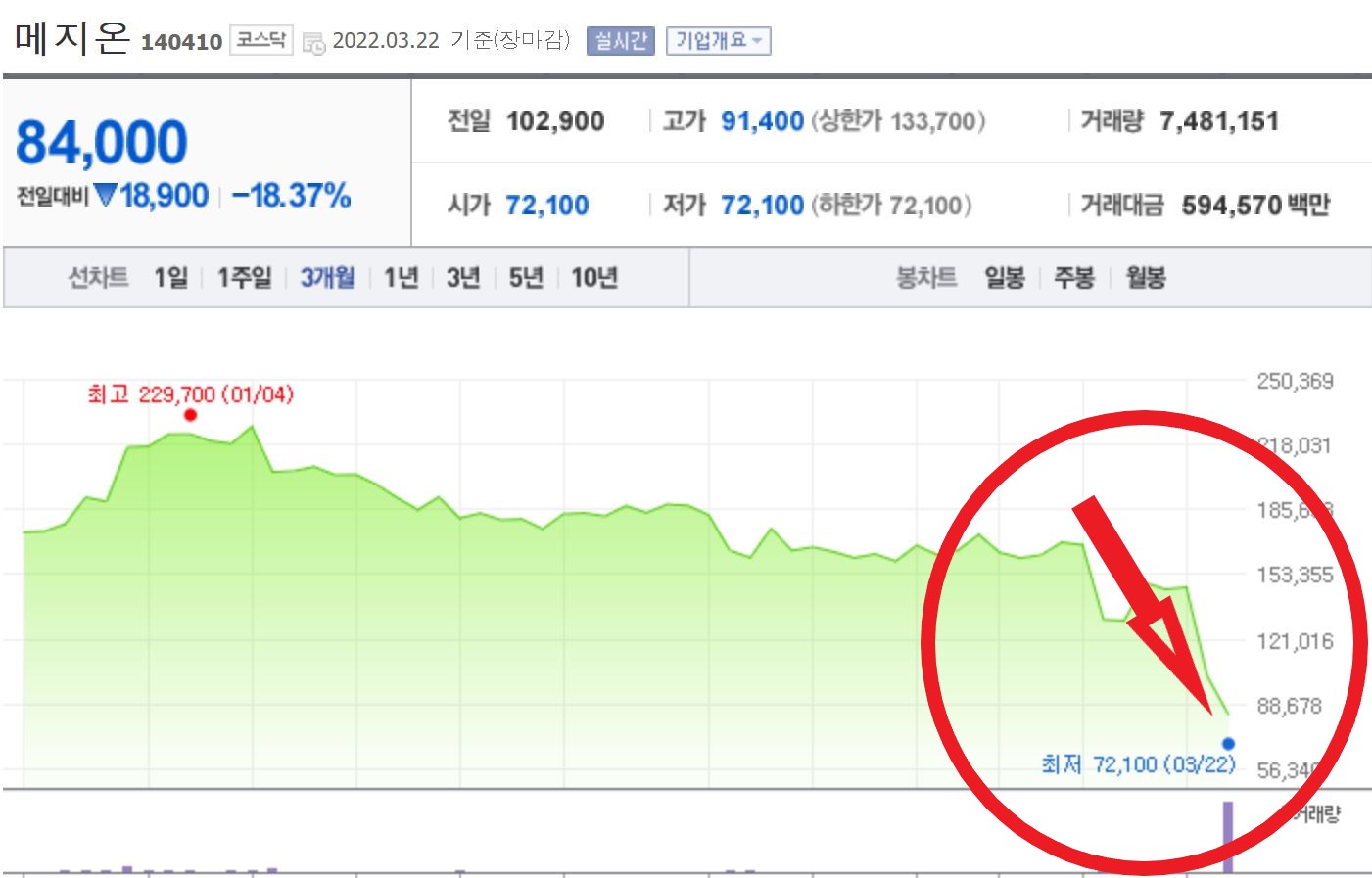
메지온이 신약 '유데나필'의 미국 식품의약국(FDA) 허가 불발 소식에 22일 장 초반 하한가를 계속 기록 중입니다.
메지온 무상증자 소식에도 주가는 계속 떨어지고 있습니다. 메지온 주가가 계속 떨어지는 이유를 알아보도록 하겠습니다.

▶ 메지온 주가 29%↓... 어제 이어 급락
▷ 무상증자 결정에도 '날개 없는 추락'
메지온이 신약 '유데나필'의 미국 식품의약국(FDA) 허가 불발 소식에 22일 장 초반 하한가를 기록 중입니다. 이날 오전 10시 4분 현재 메지온은 전 거래일 대비 27.41%까지 떨어진 7만 4700원에 거래 중입니다. 메지온은 전날에도 가격제한선(하한가)인 10만 2900원에 마감해 이틀째 주가가 급락했습니다.
▷ 메지온, 보통주 1주당 신주 2주 무상증자 결정
한편 메지온은 이날 보통주 1주당 신주 2주를 배정하는 무상증자를 결정했다고 공시했습니다. 신주배정 기준일은 오는4월 6일입니다. 신주 상장 예정일은 4월 25일 이입니다. 새로 발행되는 주식수는 1780만 2012주입니다.

만약 내가 메지온 주식을 100만 원어치 가지고 있다면, 권리락일 이후에는 보유한 메지온 주식 총액이 33만 원대로 떨어지게 되고, 인위적으로 사라진 67만 원은 신주 상장예정일에 복원된다는 뜻입니다. 물론, 향후 주가 방향에 따라 해당 금액은 차이가 날 것입니다.
이와 같이 주식 보유 상황이 인위적으로 변하게 되는 부분을 잘 파악하셔서, 메지온 투자자분들은 투자자금을 운용하는데 문제가 없도록 일정을 잘 챙기시길 바라겠습니다.
▶ 메지온, 美 신약 허가 좌초…"임상 재도전 검토"
▷ 심장 수술 부작용 약 '유데나필', FDA "임상, 통계 유의성 낮다", 허가 좌절에 주가는 하한가
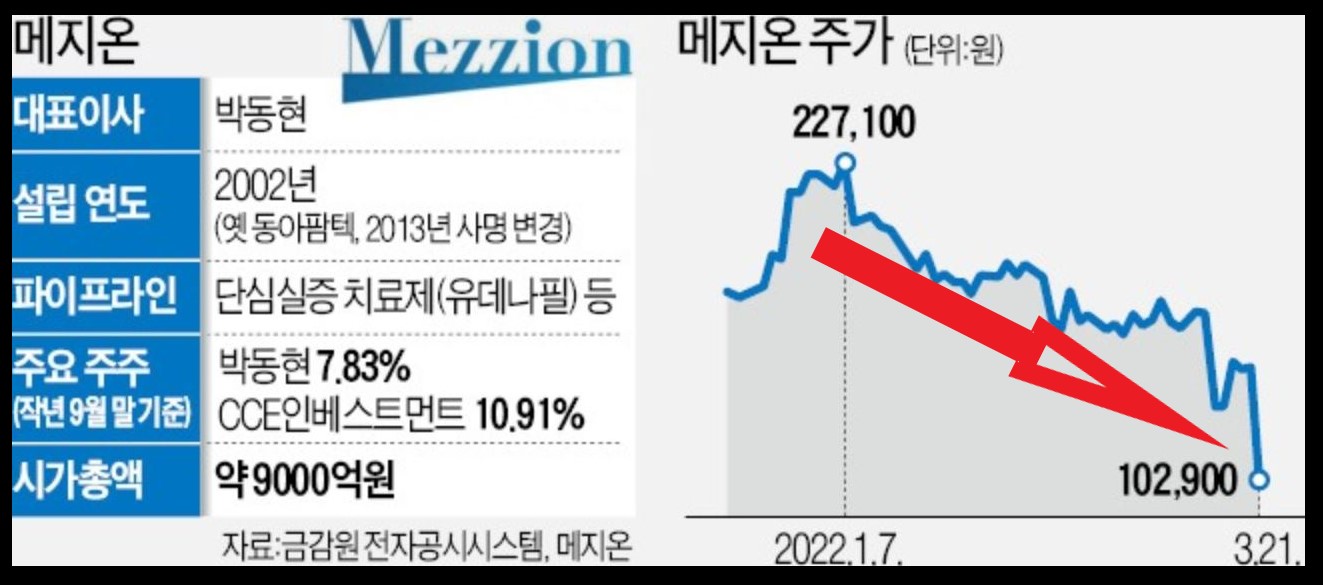
메지온이 선천성 심장 기형 수술(폰탄수술) 환자를 대상으로 개발한 신약 ‘유데나필’이 미국 식품의약국(FDA) 품목 허가를 받는 데 실패했습니다. ‘올인’하다시피 한 핵심 파이프라인(후보물질)의 허가 좌절 소식이 나온 21일 메지온 주가는 하한가로 직행했습니다.
업계에서는 유데나필의 치료 효과는 둘째로 하더라도, 임상 설계와 허가 전략의 총체적 실패라는 분석이 나왔습니다. 메지온은 이른 시일 내에 추가 임상에 나서 사태를 수습할 방침이지만 임상 설계부터 환자 모집까지 적잖은 시간이 소요될 수 있다는 우려가 제기됩니다.
▷ 메지온 재무제표 엿보기
메지온은 신약 후보 물질의 도입, 개밥, 기술이전 사업을 하는 업체입니다. 동아에스티 발기부전 치료제 아이 데나의 성분 유데나필의 북미와 러시아, 멕시코 특허 보유로 마일스톤과 국내 의료기기 부분의 매출이 주 수익원입니다.


메지온의 시가총액은 6,418억 원이며, 코스닥 115위를 기록하고 있습니다.



▷ 美 FDA “별도 임상 진행하라”
메지온이 임상 3상 결과를 바탕으로 FDA에 유데나필 품목 허가를 신청한 건 작년 3월입니다. 2020년 6월 처음 신청했지만 자료 보완에만 9개월 여가 걸렸습니다. 유데나필은 정맥혈과 동맥혈이 섞이는 선천성 심장 기형인 단심실증 환자가 받는 폰탄수술의 부작용을 줄이는 치료제입니다. 폰탄수술을 받은 환자의 혈관을 확장해 호흡과 운동 능력을 개선하는 원리입니다.


그런데 지난 3월 18일 FDA는 메지온과의 온라인 미팅에서 “임상 3상에서 나타난 1차 평가지표의 통계적 유의성이 낮다”는 의견을 전달했습니다. 1차 평가지표는 신약 후보물질이 보여야 하는 가장 핵심적인 치료 효과를 뜻합니다. 메지온은 ‘유데나필을 복용하면 최대 운동 상태에서 폰탄수술 환자의 산소 소비량이 늘어난다’는 점을 가장 중요한 치료 효과(1차 지표)로 내세웠습니다. 하지만 통계적으로 유의미한 결과를 얻지 못했습니다.
대신 메지온은 2차 지표(유산소 운동에서 무산소 운동으로 바뀌는 시점에서의 산소 소비 정도)가 유의미한 결과를 냈다며 FDA 품목 허가를 강행했습니다. 한 임상 전문가는 “1차 지표 입증에 실패해 놓고 2차 지표를 내세워 품목 허가를 신청하는 경우는 거의 없고, 성공 확률도 매우 낮다”라고 했습니다.
메지온은 여기서 그치지 않았고, 임상 3상 결과를 추가 분석했다며 통계적 유의성이 낮았던 원인으로 ‘슈퍼 폰탄 환자’를 지목했습니다. 슈퍼 폰탄 환자는 운동 능력이 일반인과 비슷해 유데나필을 복용해도 효과가 크지 않은데, 이들이 임상 3상에 대거 포함돼 있었다는 것입니다.
메지온은 뒤늦게 이들을 제외해 분석한 임상 3상 결과를 FDA 측에 제출했지만 “승인 여부를 판단하는 근거가 될 수 없다”는 답변을 받았습니다. FDA는 되레 “슈퍼 폰탄 환자를 제외한 임상시험을 별도로 하라”는 의견을 메지온에 전달했습니다.
▷ “총체적 임상 전략 실패”
업계는 메지온이 “첫 단추부터 잘못 끼웠다”라고 지적하였습니다. 신약 개발을 위한 임상 설계의 기본인 1·2차 평가지표 설정 자체에 중대한 오류가 있었다는 것입니다. 업계 관계자는 “콧물 멈추는 데 효과가 있는 약이라고 해놓고 임상에서 효과가 없는 것으로 나오자 그 대신 기침에는 효과가 있으니 허가를 해달라는 격”이라고 말하였습니다.
임상 대상자 모집 전략도 미흡했다는 지적이 있습니다. 메지온은 결과적으로 슈퍼 폰탄 환자를 임상 대상자에 포함시켜 통계적 유의성 확보 실패를 자초했다는 설명입니다. 임상 전문가는 “FDA는 후행적으로 진행한 분석 결과의 통계적 유의성을 인정하지 않는다”라고 말했습니다.
메지온은 FDA가 요구한 추가 임상에 나설 방침이리고 합니다. 회사는 “추가 임상을 한다면 슈퍼 폰탄 환자를 제외하겠다”며 “달성하고자 하는 목표 지표도 단순화하겠다”라고 했습니다. 업계는 추가 임상에 수년이 더 걸릴 것으로 보고 있습니다. 메지온이 임상 3상을 시작한 게 2016년 10월로, 2020년 6월 최초로 허가 신청을 하기까지 4년 가까이 걸렸습니다.
https://www.hankyung.com/it/article/2022032198591
메지온, 美 신약허가 좌초…"임상 재도전 검토"
메지온, 美 신약허가 좌초…"임상 재도전 검토", 심장 수술 부작용약 '유데나필' FDA "임상, 통계 유의성 낮다" 허가 좌절에 주가는 하한가 업계 "평가지표 설정 등 미흡" 추가임상 땐 수년 더 걸릴
www.hankyung.com
'경제 이모저모 > 주식 이모저모' 카테고리의 다른 글
| 우크라이나 러시아 전쟁과 국제유가 급등락 이유 (0) | 2022.03.22 |
|---|---|
| 윤석열 정책 수혜주 관련주 테마주 TOP2 총정리 (0) | 2022.03.22 |
| 주식 시장에 투자해야 하는 이유 (0) | 2022.02.22 |
| 스윙 트레이딩 의 기본 사항 (1) | 2022.02.06 |




댓글